【适应症】
EMRELIS是一种靶向c-Met的抗体与微管抑制剂偶联物,适用于治疗c-Met蛋白高表达(≥50%的肿瘤细胞呈强(3+)染色)、且已接受过先前全身治疗的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)成年患者。
【推荐剂量】
仅用于静脉输注。
• EMRELIS的推荐剂量为1.9 mg/kg,每2周静脉给药一次,直至疾病进展或出现不可耐受的毒性。
• 静脉输注前需对EMRELIS进行复溶并进一步稀释。
【不良反应】
-最常见的不良反应(≥20%):
周围神经病变、疲劳、食欲下降和周围水肿。
-最常见的3级或4级实验室检查异常(≥2%):
淋巴细胞减少、血糖升高、丙氨酸转氨酶升高、γ-谷氨酰转移酶升高、磷降低、钠降低、血红蛋白降低和钙降低。
【药理作用】
Telisotuzumab vedotin-tllv是一种靶向c-Met的抗体药物偶联物(ADC)。该抗体是一种针对c-Met(肝细胞生长因子的细胞表面受体)的人源化IgG1κ,。小分子MMAE是一种微管破坏剂,通过蛋白酶可切割的连接子与抗体相连。在与表达c-Met的细胞结合后,Telisotuzumab vedotin-tllv会被内化,并且MMAE会在细胞内被切割。MMAE会破坏活跃分裂细胞的微管网络,随后诱导细胞周期停滞和凋亡性细胞死亡。Telisotuzumab vedotin-tllv在非小细胞肺癌(NSCLC)的异种移植模型中表现出抗肿瘤活性。
【贮藏】
在2 oC至8 oC的冷藏条件下储存,置于原包装内以避光。请勿冷冻。请勿摇晃。
特殊处理
EMRELIS是一种危险产品。请遵循特殊的处理和处置程序。
【有效期】
20mg:36个月
100mg:60个月
【使用方法】
1. 患者选择
根据非鳞状非小细胞肺癌患者中是否存在高水平的c-Met蛋白过度表达[≥50%的肿瘤细胞具有强(3+)染色]来选择接受EMRELIS治疗的患者。
2. 推荐剂量
EMRELIS的推荐剂量为1.9mg/kg(对于体重大于或等于100kg的患者,最大剂量为190mg),通过静脉输注给药,每次输注时间为30分钟,每2周一次,直至疾病进展或出现不可耐受的毒性反应。
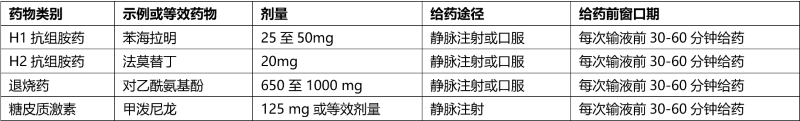
3. 发生输液相关反应患者的推荐治疗前用药
表3列出了对EMRELIS发生输液相关反应的患者在后续输液时的推荐治疗前用药。
表3:发生输液相关反应患者的推荐治疗前药物
4. 配制与给药
EMRELIS含有一种毒性成分。请按照当地要求,遵循适用的特殊处理和处置程序。
在静脉输注前,需对EMRELIS进行复溶并进一步稀释。
EMRELIS冻干粉的复溶
复溶前,将药瓶从储存环境中取出后,让其达到室温。
• 根据患者体重计算推荐剂量,以确定所需药瓶数量。对于体重大于或等于100kg的患者,使用190mg剂量。可能需要不止一个药瓶才能达到计算出的剂量。
• 使用无菌注射器,按照表4中提供的体积,将注射用无菌水缓慢注入含有冻干粉末的EMRELIS药瓶中,该冻干粉末呈完整或碎裂的饼状外观。复溶后的溶液中EMRELIS的浓度为20mg/ml。
表4. 复溶体积

• 轻轻旋转药瓶直至完全溶解。请勿摇晃。
• 检查复溶后的溶液是否有颗粒物和变色情况。溶液应呈澄清至轻微乳光状,无色至淡黄色。如果复溶后的溶液变色、浑浊或含有可见颗粒物,应丢弃该药瓶。
• 复溶后的EMRELIS应立即使用。如果不立即使用,复溶后的EMRELIS药瓶可在2°C至8°C的冰箱中储存,自复溶之时起最长可存放24小时。请勿冷冻。
• 每个EMRELIS药瓶仅供一次性使用。丢弃药瓶中剩余的未使用药物。
输液袋中的稀释
• 根据处方剂量计算所需的复溶EMRELIS溶液的剂量体积(ml)。
• 使用无菌注射器从EMRELIS小瓶中抽取计算出的复溶溶液体积(ml)。丢弃小瓶中剩余的任何未使用部分。
• 将计算量的复溶溶液注入0.9%氯化钠注射液输液袋中,使最终的EMRELIS浓度在1 mg/ml至10 mg/ml之间。仅使用0.9%氯化钠注射液。
• 轻轻倒置输液袋,使溶液充分混合。不要摇晃。
• 制备好输液剂量后,目视检查袋内内容物是否有颗粒,如有则丢弃。
• 若不立即使用,稀释后的溶液可在2°C至8°C的冰箱中储存长达24小时,并可在9°C至30°C的室温下额外存放4小时,直至给药结束。请勿冷冻。
给药方法
若制备好的输液溶液已在2°C至8°C(36°F至46°F)的冷藏条件下储存,给药前需让溶液达到室温。
• 静脉输注30分钟,使用专用精密输液管路,并配备0.20或0.22微米的内联过滤器(in line filter),过滤器材质可为聚醚砜(PES)、聚偏氟乙烯(PVDF)或聚酰胺(PA)。
• 请勿将EMRELIS与其他药物混合,也不要通过同一静脉管路给予其他药物。
【剂量调整】
不良反应的推荐减量方案见表1。
表1. 推荐的减量方案

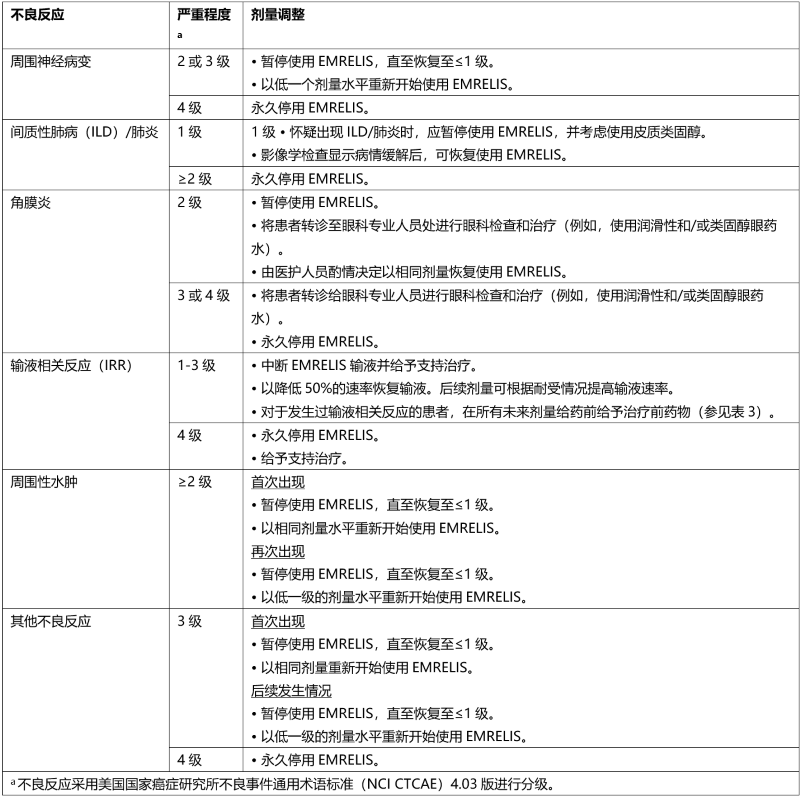
针对不良反应,EMRELIS的推荐剂量调整详见表2。
表2. 针对不良反应的EMRELIS剂量调整及处理方法
【漏服或延迟用药处理】
无相关信息
【过量处理】
无相关信息
【不良反应】
-最常见的不良反应(≥20%):
周围神经病变、疲劳、食欲下降和周围水肿。
-最常见的3级或4级实验室检查异常(≥2%):
淋巴细胞减少、血糖升高、丙氨酸转氨酶升高、γ-谷氨酰转移酶升高、磷降低、钠降低、血红蛋白降低和钙降低。
【注意事项】
• 周围神经病变:
监测患者是否出现新的或加重的周围神经病变。根据严重程度,暂停使用、减少剂量或永久停用EMRELIS。
• 间质性肺病(ILD)/肺炎:
可能会出现严重、危及生命或致命的ILD/肺炎。根据严重程度,暂停或永久停用EMRELIS。(5.2)
• 眼表疾病:
监测患者是否出现眼表疾病的症状或症状,包括视力变化。根据严重程度,暂停或永久停用EMRELIS。(5.3)
• 输液相关反应(IRR):
监测患者是否出现输液相关反应。根据严重程度,暂停输注、降低输注速度或永久停用EMRELIS。对于出现输液相关反应的患者,在后续输注前给予治疗前用药。
• 胚胎-胎儿毒性:
可能会对胎儿造成伤害。告知患者对胎儿的潜在风险,并建议使用有效的避孕措施。
【禁忌】
无
【特殊人群】
妊娠期:
根据动物研究结果及其作用机制,本品给孕妇服用时可能会造成胎儿伤害。
不孕症:
女性
根据含MMAE的抗体药物偶联物(ADCs)在动物研究中的发现,EMRELIS可能会损害女性生育能力。其对生育能力的影响是可逆的.
男性
根据动物研究的结果,EMRELIS可能会损害男性的生育能力。这种影响是否可逆尚不清楚。
哺乳期:
建议女性在使用本品治疗期间以及最终剂量后至少1个月内不要母乳喂养。
儿童:
尚未确定本品对儿童患者的安全性和有效性。
老年患者:
与年轻患者相比,没有观察到老年患者在安全性或有效性方面的临床上重要的差异。
肝损伤患者:
中度或重度肝功能损害(总胆红素>1.5×ULN且伴任何AST)的患者应避免使用EMRELIS。
中度或重度肝功能损害的患者对MMAE的暴露量可能会增加,这可能会提高不良反应的发生风险。尚未在中度或重度肝功能损害患者中对EMRELIS进行研究。
对于轻度肝功能不全患者(总胆红素≤ULN且AST>ULN,或总胆红素>ULN和≤1.5×ULN且伴随任意AST),不建议调整剂量。
【适应症】
EMRELIS是一种靶向c-Met的抗体与微管抑制剂偶联物,适用于治疗c-Met蛋白高表达(≥50%的肿瘤细胞呈强(3+)染色)、且已接受过先前全身治疗的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)成年患者
【药物相互作用】
强效CYP3A抑制剂:与EMRELIS联合使用可能会增加MMAE的血药浓度-时间曲线下面积(AUC)。需监测EMRELIS不良反应风险的增加情况。
请按药品说明书或在药师指导下购买和使用



 在线咨询
在线咨询 400-001-9769
400-001-9769
