【适应症】
本品是一种双特异性靶向delta样配体3(DLL3)和 T细胞 CD3的衔接蛋白,适用于治疗在铂类化疗期间或之后出现疾病进展的广泛期小细胞肺癌(ES-SCLC)成年患者。
【推荐剂量】
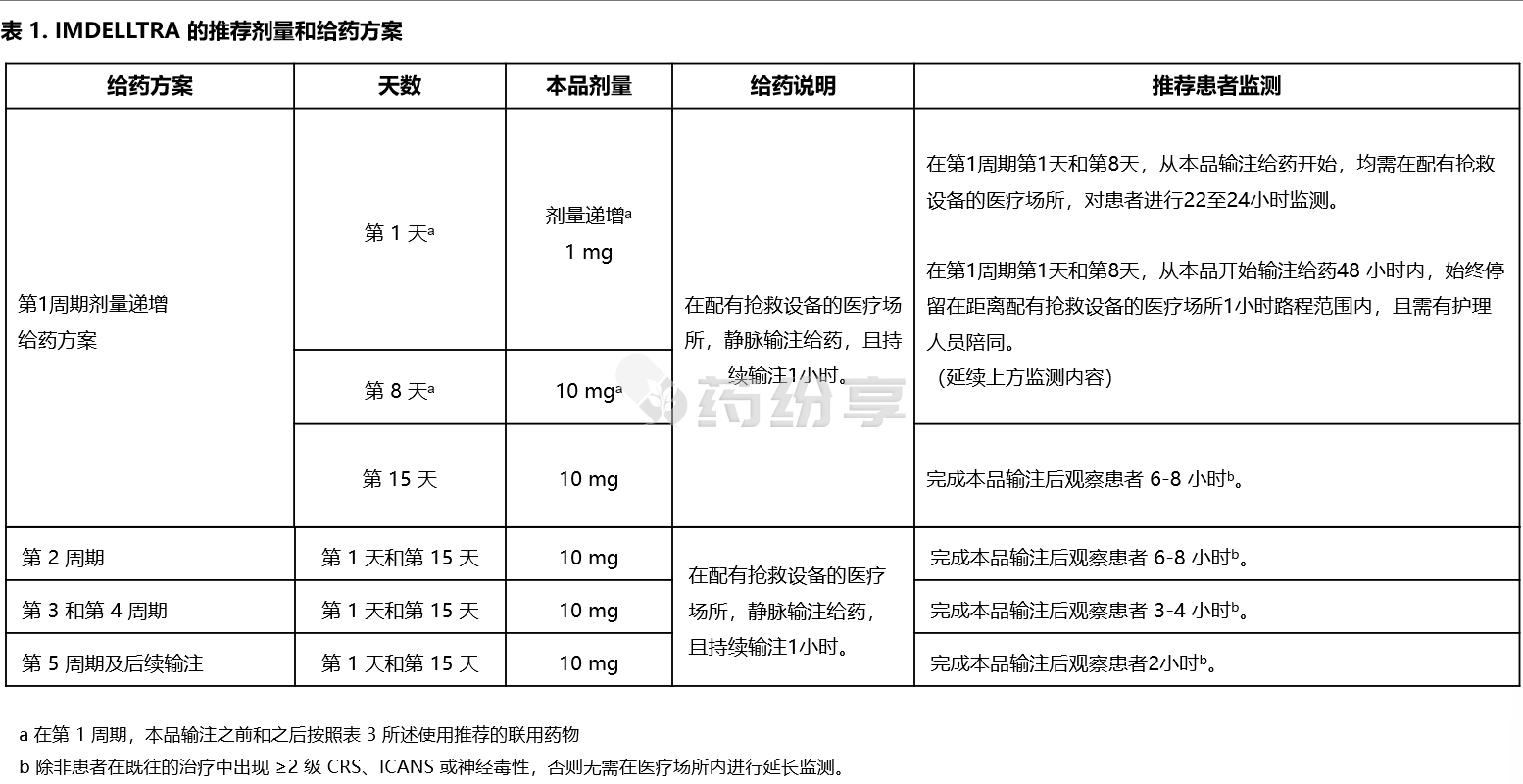
• 静脉输注给药,持续输注 1 小时。
•按照表 1 中的逐步递增给药方案使用本品,以降低细胞因子释放综合征的风险。
• 按照推荐使用联用药物。
• 在第1周期第1天和第8天,从本品输注给药开始,均需在配有抢救设备的医疗场所对患者进行22至24小时的监测。
• 建议患者在第1周期第1天和第8天,从本品开始输注给药48 小时内,始终停留在距离配有抢救设备的医疗场所1小时路程范围内,且需有护理人员陪同。
•有关制备和给药的说明,请参阅完整处方信息。
【不良反应】
最常见的不良反应(≥20%)是细胞因子释放综合征、疲劳、发热、味觉障碍、食欲下降、肌肉骨骼疼痛、便秘、贫血和恶心。
最常见的 3 级或 4 级实验室异常(≥2%)是淋巴细胞减少、钠减少、尿酸增加、总中性粒细胞减少、血红蛋白减少、活化部分凝血活酶时间增加、钾减少、天冬氨酸转氨酶增加、白细胞减少、血小板减少和丙氨酸转氨酶增加。
【药理作用】
本品 是一种双特异性 T 细胞接合剂,可与细胞(包括肿瘤细胞)表面表达的 DLL3 和 T 细胞表面表达的 CD3 结合。本品可激活 T 细胞、释放炎性细胞因子以及裂解 DLL3 表达细胞。本品在小鼠 SCLC 模型中具有抗肿瘤活性。
【贮藏】
将本品 和 IV 溶液稳定剂 (IVSS) 小瓶冷藏在 2°C 至 8°C (36°F 至 46°F) 的原包装盒中,避免光照直至使用。请勿冷冻。本品和 IV 溶液稳定剂 (IVSS) 小瓶可在原包装盒中室温下保存在 20°C 至 25°C (68°F 至 77°F) 之间,最多可保存 24 小时,避免光照。
【有效期】
30个月
【推荐剂量】
• 静脉输注给药,持续输注 1 小时。
•按照表 1 中的逐步递增给药方案使用本品,以降低细胞因子释放综合征的风险。
• 按照推荐使用联用药物。
• 在第1周期第1天和第8天,从本品输注给药开始,均需在配有抢救设备的医疗场所对患者进行22至24小时的监测。
• 建议患者在第1周期第1天和第8天,从本品开始输注给药48 小时内,始终停留在距离配有抢救设备的医疗场所1小时路程范围内,且需有护理人员陪同。
•有关制备和给药的说明,请参阅完整处方信息。

【使用方法】
-可使用用于联合用药的静脉 (IV) 导管来输注本品。
-为确保通畅,使用 0.9% 注射用氯化钠冲洗静脉导管 3-5 分钟。
-使用输液泵以固定速度输注配制和稀释的本品 。输液泵应可编程、可锁定、非弹性且具有警报。
-表 2 提供了输液持续时间和速度。

建议使用的联合用药

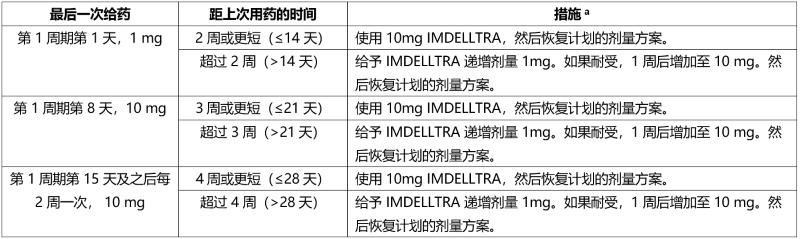
延迟用药后重新开始使用 IMDELLTRA
如果本品需要延迟给药,请根据表 4 中的建议重新开始治疗,并相应地恢复用药计划。
表 4. 延迟用药后重新开始 IMDELLTRA 治疗的建议
a 在第 1 周期输注 IMDELLTRA之前和之后使用推荐的联用药物,并相应地监测患者。
制备
材料兼容性信息
• 由乙烯醋酸乙烯酯 (EVA)、聚烯烃和聚氯乙烯 (PVC) 组成的静脉输液袋已被证明在特定给药条件下与 IMDELLTRA 兼容。
• 由聚烯烃、PVC 和聚氨酯组成的静脉输液管和导管材料已被证明在特定给药条件下与 IMDELLTRA 兼容。
• 由于可能存在错误剂量用药风险,不建议使用封闭系统转移装置 (CSTD)。安进(Amgen)尚未对药瓶适配器 CSTD 与 IMDELLTRA 进行兼容性测试。
步骤 1:用注射用无菌水配制 IMDELLTRA
• 表 8 提供了配制 IMDELLTRA 1 mg 和 10 mg 小瓶所需的注射用无菌水量。
请勿使用静脉注射液稳定剂 (IVSS) 配制 IMDELLTRA。
静脉注射液稳定剂 (IVSS) 用于添加配制的 IMDELLTRA 之前覆盖静脉注射袋,以防止 IMDELLTRA 吸附到静脉注射袋和静脉注射管上。
表 8. 配制IMDELLTRAa 所需的注射用无菌水量

a 每个小瓶均含有多余填充物,以便在配制后抽取 1.1 ml(1 mg小瓶)或 4.2 ml(10 mg小瓶),以确保按照标示的小瓶规格的规定浓度进行输送。
• 使用装有所需量无菌水的针头和注射器,沿瓶壁将无菌水注入玻璃瓶。避免将水直接注入粉末以防止起泡。
• 轻轻旋转内容物以混合。不要摇晃。
• 给药前检查肠外药物产品是否有颗粒物和变色。检查溶液是否清澈至乳白色、无色至微黄色。如果溶液浑浊或有颗粒,请勿使用。
• 进一步稀释配制的 IMDELLTRA。
• 配制的 IMDELLTRA 必须在配制后 4 小时内进一步稀释或丢弃。
准备输液袋:步骤 2 至 5
步骤 2:抽取注射用 0.9% 氯化钠
• 使用 250 mL 预装的注射用 0.9% 氯化钠袋,抽取表 9 中规定量的氯化钠并丢弃。
表 9. 从 250 mL 静脉输液袋中抽取的 0.9% 氯化钠所需量

步骤 3:将静脉输液稳定剂加入输液袋
• 将 13 mL 静脉输液稳定剂 (IVSS) 注入 250 mL 0.9% 氯化钠输液袋,见表 10。
• 轻轻混合输液袋内容物以避免起泡。请勿摇晃。
表 10. 需要添加到静脉输液袋中的静脉输液稳定剂 (IVSS) 的量

步骤 4:将配制的 IMDELLTRA 稀释到输液袋中
• 将表 11 中列出的配制的 IMDELLTRA 所需容量转移到输液袋中(包含 IV 溶液稳定剂)。
注意:在配制和进一步稀释后,不同规格小瓶的最终浓度并不相同。
表 11. 需要加入 250 mL IV 袋的配制 IMDELLTRA溶液 的量

• 轻轻混合袋中的内容物。不要摇晃。
步骤 5:从静脉输液袋中排出空气
使用空注射器从准备好的静脉输液袋中排出空气以避免起泡。
步骤 6:冲洗静脉输液管路
• 使用 0.9% 注射用氯化钠或最终制备的溶液冲管。
• 参见表 12,了解准备好的 IMDELLTRA 溶液的最长储存时间。
准备好的 IMDELLTRA 输液袋储存要求
• 立即注射配制和稀释的 IMDELLTRA。
• 表 12 显示了准备好的 IMDELLTRA 输液袋的最长储存时间。
• 最长储存时间包括从配制 IMDELLTRA 小瓶到输液结束的总时间。
表 12. 最长存储时间

【剂量调整】
不建议减少 IMDELLTRA 剂量。请参阅表 5 和表 6 分别了解 CRS、神经毒性(包括 ICANS)的管理建议措施,以及表 7 了解血细胞减少症、感染和其他不良反应。
细胞因子释放综合征 (CRS)
根据临床表现诊断 CRS 。评估并治疗发烧、缺氧和低血压的其他原因。
如果怀疑是 CRS,请按照表 5 中的建议进行治疗。使用连续心脏监护和脉搏血氧仪监测经历 2 级或更高 CRS(例如,对液体没有反应的低血压,或需要供氧的缺氧)的患者。
对于严重或危及生命的 CRS,建议使用托珠单抗或等效疗法,并进行强化监测(例如,ICU)以进行支持性治疗。进行实验室检测以监测弥漫性血管内凝血 (DIC)、血液学参数以及肺、心脏、肾和肝功能。
表 5 提供了细胞因子释放综合征的分级和剂量调整和管理指南。
表 5. 细胞因子释放综合征的分级和剂量调整及管理指南a
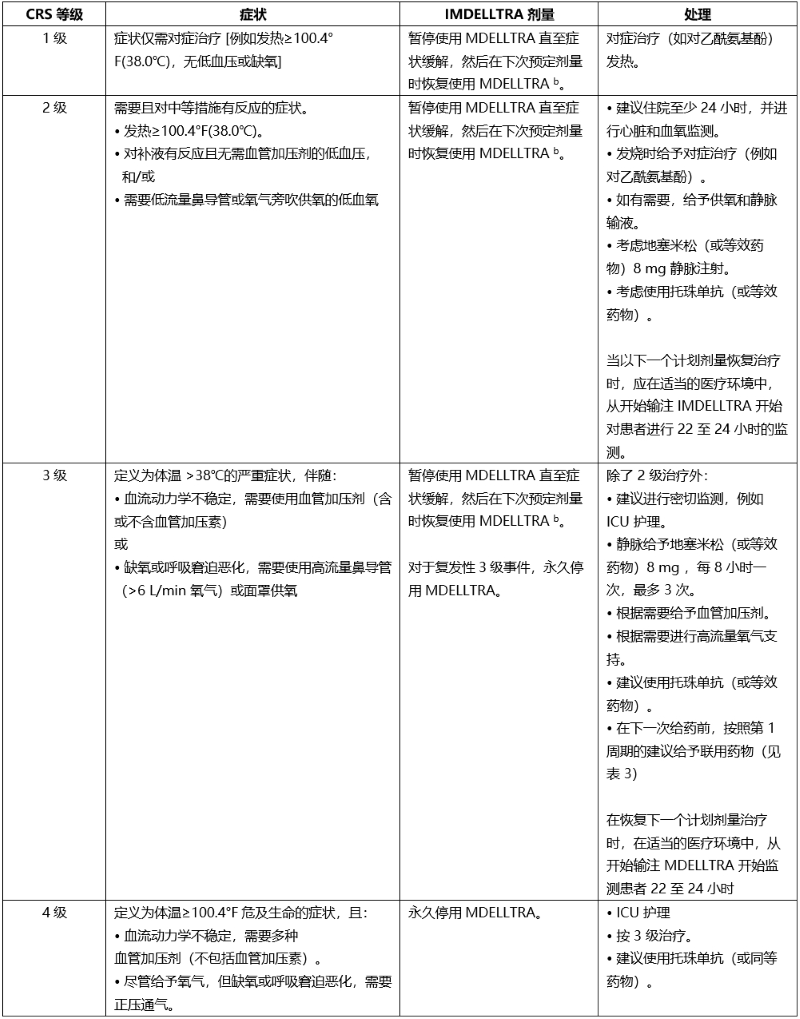
a CRS 基于美国移植和细胞治疗协会 (ASTCT) 共识分级 (2019)。
b 有关剂量延迟后重新开始使用 IMDELLTRA 的建议,请参阅表 4 。
c 按照标准护理指南逐渐减少类固醇剂量。
神经毒性,包括 ICANS
一出现神经毒性(包括 ICANS)症状,应暂停使用 IMDELLTRA 并考虑进行神经系统评估。排除引起神经系统症状的其他原因。对严重或危及生命的神经毒性(包括 ICANS)提供支持性治疗,可能包括重症监护。根据表 6 中的建议处理ICANS 和神经毒性,并考虑根据现行实践指南进行进一步处理。
表 6. 神经毒性管理指南(包括免疫效应细胞相关神经毒性综合征)a
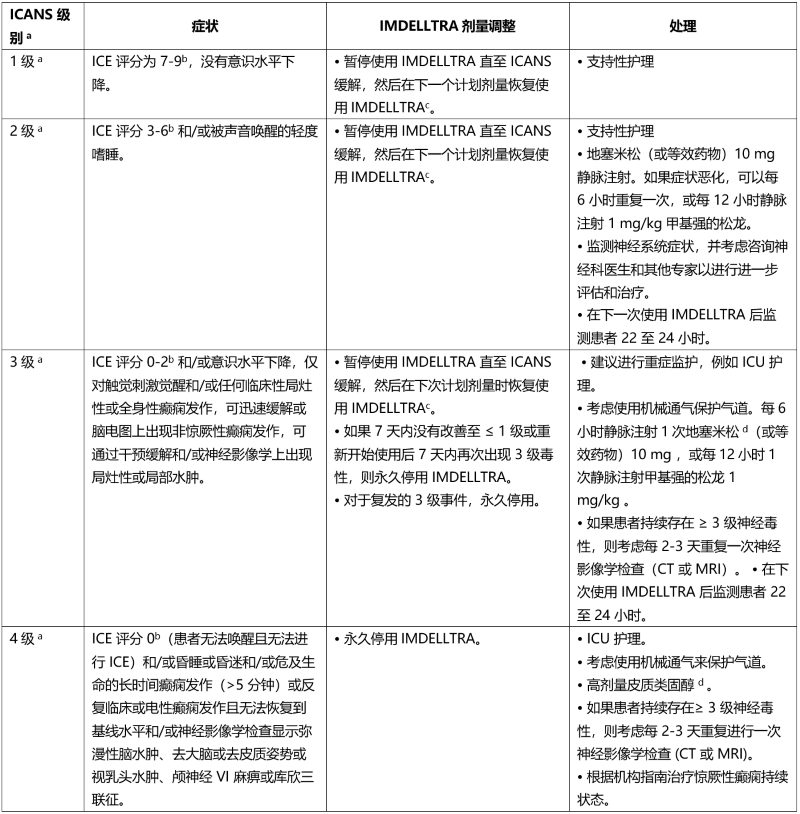
a ICANS 基于美国移植和细胞治疗协会 (ASTCT) 共识评分 (2019)
b 如果患者可唤醒并能够进行免疫效应细胞相关脑病 (ICE) 评估,则评估:定向能力 (定向年份、月份、城市、医院 = 4 分);命名能力 (说出 3 个物体的名称,例如指向时钟、笔、按钮 = 3 分);遵循命令 (例如,“给我看 2 根手指”或“闭上眼睛伸出舌头”= 1 分);写作能力 (写出标准句子的能力 = 1 分);注意力 (从 100 开始以 10 为单位倒数 = 1 分)。如果患者无法唤醒并且无法进行 ICE 评估 (4 级 ICANS) = 0 分。
c 请参阅表 4,了解延迟用药后重新开始使用 IMDELLTRA 的建议。
d 按照标准护理指南减少类固醇用量。
表 7. 为管理血细胞减少症、感染和其他不良反应而建议的 IMDELLTRA 治疗中断
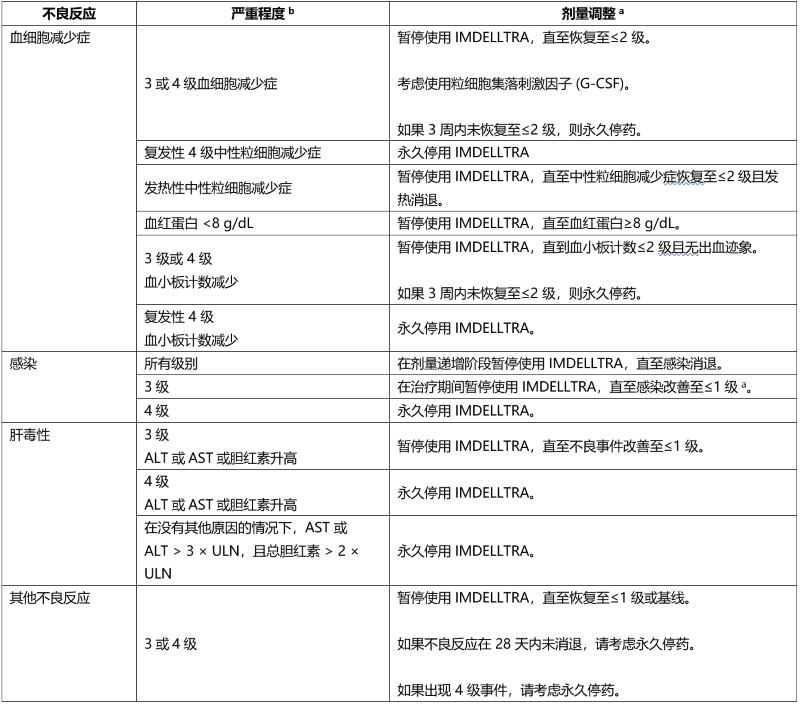
a 请参阅表 4 了解重新开始剂量的指导。
b 严重程度基于美国国家癌症研究所不良事件常用术语标准 (NCI CTCAE) 5.0 版。
【漏服或延迟给药处理】
延迟用药后重新开始使用 IMDELLTRA
如果延迟使用 IMDELLTRA,请根据表 4 中的建议重新开始治疗,并相应地恢复用药计划。
表 4. 延迟用药后重新开始 IMDELLTRA 治疗的建议
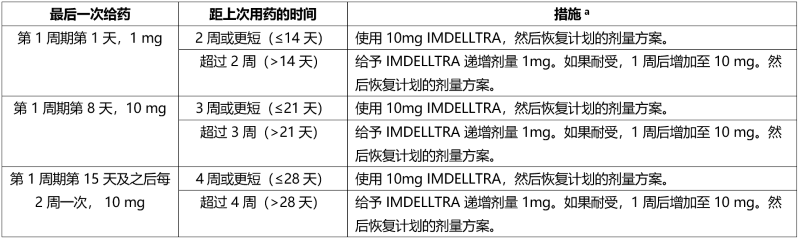
a 在第 1 周期输注 IMDELLTRA之前和之后使用推荐的联用药物,并相应地监测患者。
【过量处理】
无相关信息
【不良反应】
最常见的不良反应(≥20%)是细胞因子释放综合征、疲劳、发热、味觉障碍、食欲下降、肌肉骨骼疼痛、便秘、贫血和恶心。
最常见的 3 级或 4 级实验室异常(≥2%)是淋巴细胞减少、钠减少、尿酸增加、总中性粒细胞减少、血红蛋白减少、活化部分凝血活酶时间增加、钾减少、天冬氨酸转氨酶增加、白细胞减少、血小板减少和丙氨酸转氨酶增加。
【注意事项】
-血细胞减少症:
在使用本品治疗前、每次用药前以及根据临床指征监测全血细胞计数。根据严重程度暂停或永久停药。
-感染:
监测感染的症状和体征;适当治疗。根据严重程度暂停或永久停药。
-肝毒性:
在使用本品治疗前、每次服药前以及临床指征时监测肝酶和胆红素。根据严重程度暂停或永久停药。
-超敏反应:
监测超敏反应的体征和症状并进行相应治疗。根据严重程度暂停或永久停药。
-胚胎-胎儿毒性:
可能对胎儿造成伤害。建议有生育能力的女性注意胎儿的潜在风险并使用有效的避孕措施。
【禁忌】
无
【特殊人群】
妊娠期:
根据其作用机制,本品给孕妇使用时可能会造成胎儿伤害。
哺乳期:
建议女性在使用本品治疗期间以及最终剂量后至少2个月内不要母乳喂养。
儿童:
尚未确定本品对儿童患者的安全性和有效性。
老年患者:
在老年患者(≥ 65 岁)和年轻患者之间,IMDELLTRA 药代动力学或安全性没有总体差异。本品的临床研究没有包括足够数量的65岁及以上患者,以确定他们的反应是否与年轻患者不同。与年轻患者相比,没有观察到≥65岁患者在安全性或有效性方面的临床上重要的差异。
【适应症】
本品是一种靶向双特异性 delta 样配体 3(DLL3)的 CD3 T 细胞接合剂,用于治疗在铂类化疗期间或之后病情进展的广泛期小细胞肺癌(ES-SCLC)成年患者。
【药物相互作用】
无相关信息




 在线咨询
在线咨询 400-001-9769
400-001-9769
