【适应症】
本品是一种 1 型人类免疫缺陷病毒(HIV-1)衣壳抑制剂,用于暴露前预防(PrEP),以降低体重至少35kg的成人和青少年通过性接触感染 HIV-1的风险。启动 本品治疗前,必须确认个体的 HIV-1 检测结果为阴性(排除已感染 HIV 的情况)。
【推荐剂量】
在使用本品期间,需按以下要求进行 HIV-1 感染筛查:
-启动用药前:必须对所有患者进行 HIV-1 筛查(确认阴性方可用药)。
-每次注射前:每次给予本品注射前,均需再次筛查 HIV-1。
-临床需要时:根据患者临床情况(如出现疑似感染症状、暴露风险变化等),额外增加筛查次数。
表 1. 体重至少 35 公斤的成人和青少年使用 YEZTUGO 的起始和维持给药方案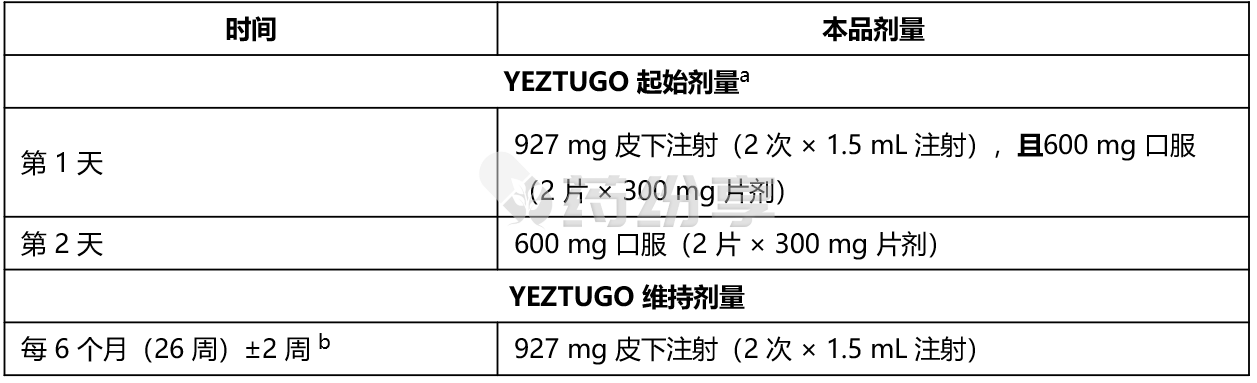
a:需遵循完整的起始给药方案(包含皮下注射和口服片剂);本品的疗效仅在该给药方案下被验证。
b:自最后一次注射之日起计算。
【不良反应】
最常见的不良反应(≥5%,所有严重程度分级):注射部位反应、头痛和恶心。
【药理作用】
来那卡帕韦是一种多阶段、选择性的 HIV-1 衣壳功能抑制剂,可直接与六聚体中衣壳蛋白(p24)亚基之间的界面结合。表面等离子体共振传感图显示,来那卡帕韦与交联野生型衣壳六聚体呈剂量依赖性和饱和性结合,平衡结合常数(KD)为 1.4 nM。来那卡帕韦通过干扰病毒生命周期的多个关键步骤来抑制 HIV-1 复制,包括衣壳介导的 HIV-1 前病毒 DNA 的核摄取(通过阻断核输入蛋白与衣壳的结合)、病毒组装和释放(通过干扰 Gag/Gag-Pol 的功能,减少衣壳蛋白亚基的产生)以及衣壳核心形成(通过破坏衣壳亚基结合的速率,导致畸形衣壳的形成)。
【贮藏】
在20 °C – 25 °C温度下保存;允许在15 °C – 30 °C温度范围波动。
【有效期】
24个月
【使用方法】
-本品剂型分为片剂和注射液
-片剂为口服用药,随餐或空腹服用均可。
-注射液为皮下注射给药,方法如下:
本品注射剂仅供医疗专业人员进行腹部或大腿区域内皮下注射。严禁皮内注射,否则可能引发严重的注射部位反应。
需采用无菌操作技术。给药前,应目视检查小瓶和已准备好的注射器内的溶液是否存在颗粒物或变色情况。本品注射液为黄色溶液。若溶液变色或含有颗粒物,请勿使用。一旦从药瓶中抽出溶液,应尽快进行皮下注射给药,完整剂量需要进行两次 1.5 毫升的注射。
【推荐剂量】
在使用本品期间,需按以下要求进行 HIV-1 感染筛查:
-启动用药前:必须对所有患者进行 HIV-1 筛查(确认阴性方可用药)。
-每次注射前:每次给予本品注射前,均需再次筛查 HIV-1。
-临床需要时:根据患者临床情况(如出现疑似感染症状、暴露风险变化等),额外增加筛查次数。
表 1. 体重至少 35 公斤的成人和青少年使用 YEZTUGO 的起始和维持给药方案
a:需遵循完整的起始给药方案(包含皮下注射和口服片剂);本品的疗效仅在该给药方案下被验证。
b:自最后一次注射之日起计算。
【剂量调整】
-与强效 CYP3A 诱导剂联用时的剂量:
表 4. 接受 YEZTUGO 治疗且仅在启动治疗时联合使用强效 CYP3A 诱导剂的患者给药建议a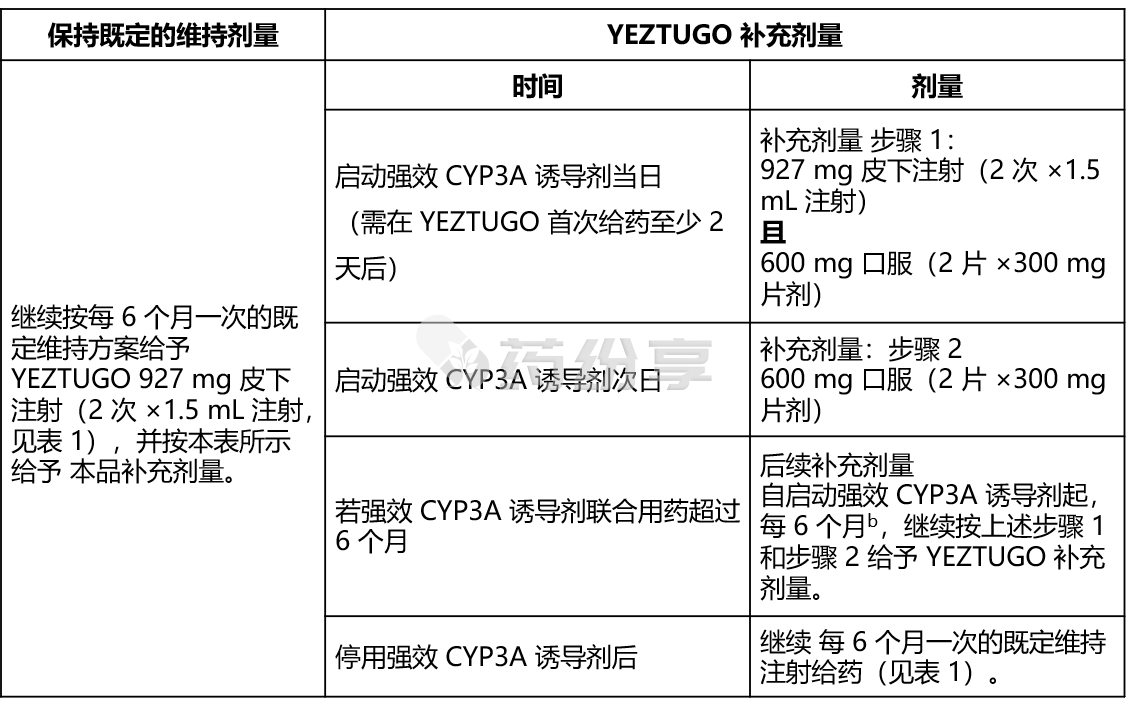 注:
注:
a. 对于已在使用强效CYP3A 诱导剂的患者启动 YEZTUGO 治疗或接受 YEZTUGO 每周口服剂量(参见表 2)的患者,尚无相关给药建议。
b. 26 周 ±2 周。
-与中效 CYP3A 诱导剂联用时的剂量:
表 5. 接受 YEZTUGO治疗并仅在启动治疗时联合使用中效 CYP3A 诱导剂治疗的患者给药建议a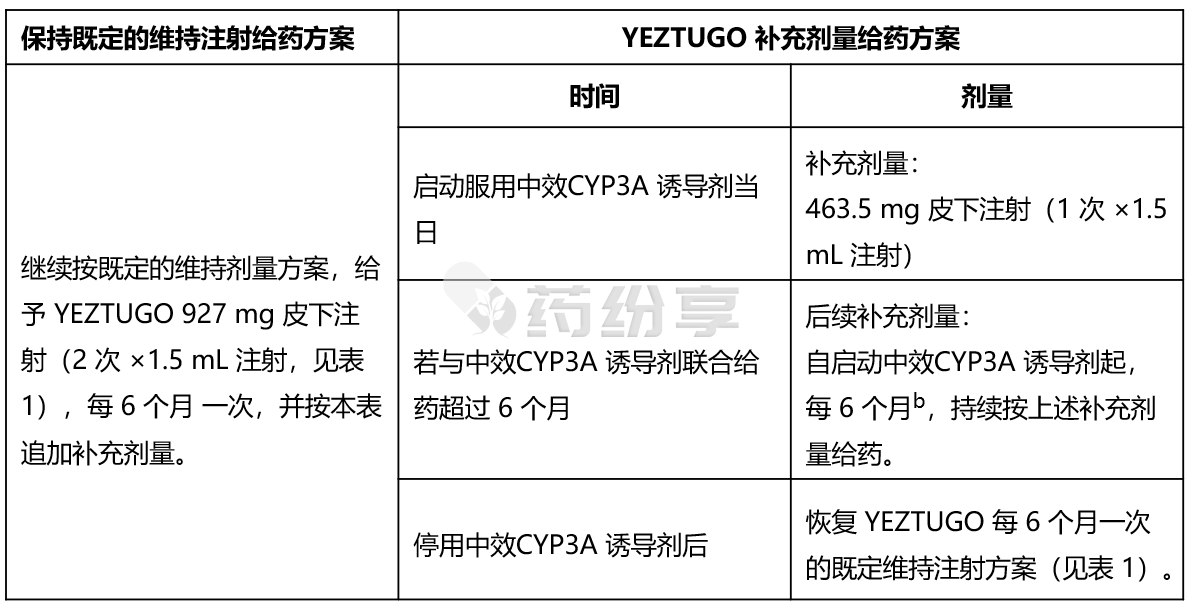
注:
a. 对于已在使用中效 CYP3A 诱导剂的患者启动 YEZTUGO 治疗,或接受 YEZTUGO 每周口服剂量(参见表 2)的患者,尚无相关给药建议。
b. 26 周 ±2 周。
【服用过量处理】
目前尚无本品药物过量的相关数据。若发生药物过量,需监测患者是否出现毒性反应。本品药物过量的治疗包括一般支持性措施,如监测生命体征及观察患者的临床状态。由于来那卡帕韦与血浆蛋白的结合率极高,透析不太可能显著清除该药物。
【漏服处理】
若漏服起始阶段第 2 天的口服剂量(600 毫克,详见表 1),请尽快补服。请勿在同一天服用第 1 天和第 2 天的起始阶段口服剂量。
-预计延迟注射
在维持给药期间,若预计原计划的每 6 个月一次的注射将延迟超过 2 周,可临时服用 YEZTUGO 片剂(最长维持6 个月),直至恢复注射。延迟注射的给药方案请参考下表 2。
表 2. 预计延迟注射时的给药方案:每周口服剂量
a 仅作临时使用(必要时最长可维持 6 个月)。
-漏打注射剂量
若患者错过计划注射剂量,应重新进行临床评估,以确保继续使用 YEZTUGO 仍是合适的,且患者 HIV-1 检测仍为阴性。在维持给药期间,如果距上次注射已超过 28 周,且未服用 YEZTUGO 片剂,请参考下表 3 中关于漏打注射剂后的给药方案。强烈建议患者严格遵循注射给药计划。
【不良反应】
最常见的不良反应(≥5%,所有严重程度分级):注射部位反应、头痛和恶心。
【注意事项】
-降低 HIV-1 感染风险的综合管理措施。
-患者在接受本品之前、用药期间或停用本品后感染 HIV-1,可能会产生对来那卡帕韦的耐药性风险。每次注射前以及根据临床需要额外进行检测,以确认 HIV-1 阴性状态。
-来那卡帕韦在体循环中的残留浓度可能持续长达 12 个月或更久。
-不恰当的给药方式(如皮内注射)可能引发严重的注射部位反应。
【禁忌】
HIV-1 状态未知或阳性者,禁用本品。
【特殊人群】
-孕妇:
来自一项关于妊娠期使用本品的随机对照试验(PURPOSE 1)的现有数据显示,与活性对照组相比,未发现该药物存在与药物相关的流产风险,也未发现对母体或胎儿有不良结局。
-哺乳期:
来那卡帕韦可存在于人乳中。在接受本品治疗期间怀孕的患者所母乳喂养的婴儿体内,检测到了极低水平的来那卡帕韦。尚未观察到来那卡帕韦对母乳喂养婴儿产生的不良影响。目前尚不清楚本品是否会影响乳汁分泌。
-儿科患者:
本品在体重不足35kg的儿科人群中的安全性、有效性及药代动力学尚未确立。
-老年人:
本品的临床研究未纳入足够数量的 65 岁及以上受试者,因此无法确定这一人群与年轻患者在药物反应上是否存在差异。通常而言,在给老年患者使用本品时应谨慎行事,这是因为老年人肝功能、肾功能或心功能下降的发生率更高,且常伴随其他疾病或接受其他药物治疗。
-肾功能损伤患者:
对于轻度、中度或重度肾功能损害患者(估算肌酐清除率≥15ml / 分),不建议调整 本品的剂量。本品尚未在终末期肾病(ESRD)患者中进行研究。
-肝功能损伤患者:
对于轻度(Child-Pugh A 级)或中度(Child-Pugh B 级)肝功能损伤患者,不建议调整本品的剂量。本品尚未在重度肝功能损害(Child-Pugh C 级)患者中进行研究。
【适应症】
本品是一种 1 型人类免疫缺陷病毒(HIV-1)衣壳抑制剂,用于暴露前预防(PrEP),以降低体重至少35kg的成人和青少年通过性接触感染 HIV-1的风险。启动 本品治疗前,必须确认个体的 HIV-1 检测结果为阴性(排除已感染 HIV 的情况)。
【药物相互作用】
1、其他药物对本品的影响:
来那卡帕韦是 P - 糖蛋白(P-gp)、尿苷二磷酸葡萄糖醛酸转移酶 1A1(UGT1A1)和 CYP3A 的底物。
-强效或中效 CYP3A 诱导剂
强效或中效 CYP3A 诱导剂可能显著降低来那卡帕韦的血浆浓度,从而降低本品的疗效。因此,在启动强效或中效 CYP3A 诱导剂治疗时,建议对本品进行剂量调整(补充剂量)。
-P-gp、UGT1A1 和强效 CYP3A 抑制剂的联用
P-gp、UGT1A1 和强效 CYP3A 抑制剂的联用可能显著升高本品的血浆浓度。因此,不建议本品与这些抑制剂同时给药。
2、本品对其他药物的影响:
-CYP3A 和 P-gp 底物
来那卡帕韦是 CYP3A 的中度抑制剂和 P - 糖蛋白(P-gp)抑制剂。
本品与 CYP3A 或 P-gp 的敏感底物联用时,可能升高这些底物的浓度,从而增加其不良反应风险。请参考这些敏感底物的处方信息,以获取给药建议或安全性监测的指导。
由于皮下注射来那卡帕韦后其半衰期较长,本品可能会增加在最后一次皮下注射本品后 9 个月内启动的、主要经 CYP3A 代谢的药物的暴露量。
3、与本品无临床显著相互作用的药物:
根据对本品进行的药物相互作用研究,以下药物与本品联用时未观察到临床显著的药物相互作用:阿托伐他汀、法莫替丁、匹伐他汀、瑞舒伐他汀、替诺福韦艾拉酚胺和伏立康唑。


 在线咨询
在线咨询 400-001-9769
400-001-9769
