【适应症】
本品是一种靶向GPRC5D和T细胞 CD3的双特异性结合抗体,适用于治疗复发性或难治性多发性骨髓瘤的成年患者,这些患者之前至少接受过四种疗法,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
【推荐剂量】
• 用于皮下注射。
• 在完成递增剂量方案中的所有剂量给药后,患者应住院48小时。
• 按照建议服用预处理药物。
【不良反应】
最常见的不良反应(≥20%):发热、细胞因子释放综合征(CRS)、味觉障碍、指甲异常、肌肉骨骼疼痛、皮肤异常、皮疹、疲劳、体重下降、口干、皮肤干燥 、吞咽困难、上呼吸道感染、腹泻、低血压和头痛。
最常见的3级或4级实验室异常(≥30%):淋巴细胞计数减少、中性粒细胞计数减少、白细胞减少和血红蛋白减少。
【药理作用】
本品是一种双特异性T细胞结合抗体,其结合在T细胞表面表达的CD3受体和在多发性骨髓瘤细胞和非恶性浆细胞以及健康组织(如皮肤和舌头角质化组织中的上皮细胞)表面表达的G蛋白偶联受体C类第5组成员D(GPRC5D)。
在体外,本品激活的T细胞引起促炎细胞因子的释放,并导致多发性骨髓瘤细胞的裂解。本品在多发性骨髓瘤小鼠模型中具有抗肿瘤活性。
【贮藏】
在原包装盒中冷藏保存,温度为 2°C 至 8°C(36°F 至 46°F),避光。
不要冷冻。
【有效期】
18个月
【使用方法】
1. 重要的剂量信息
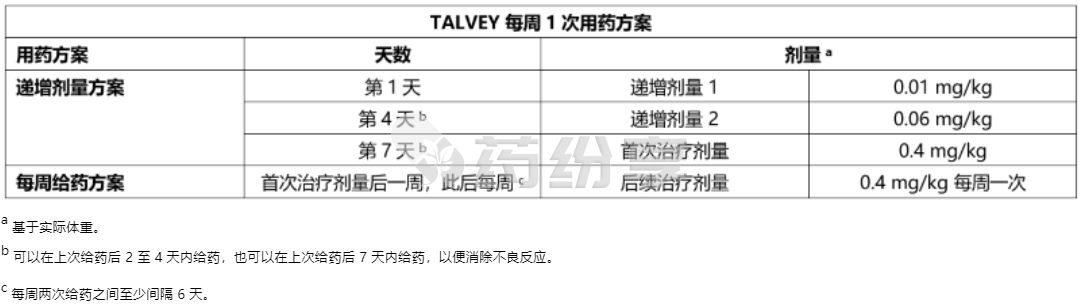
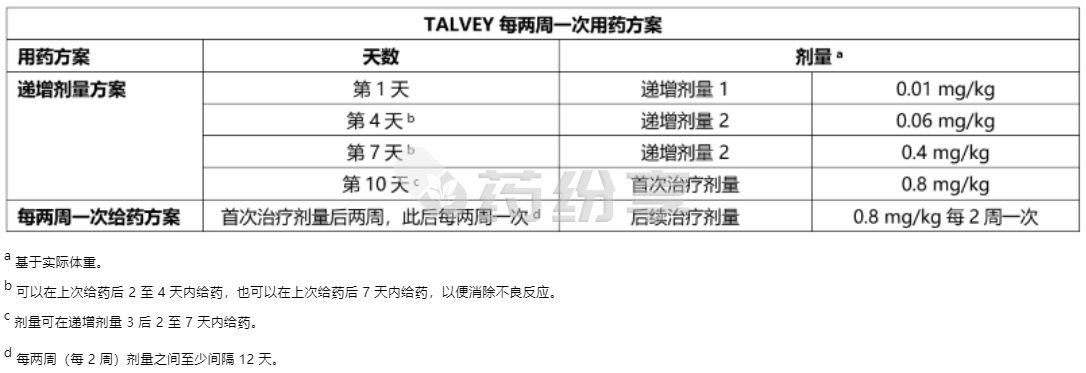
• 根据表 1 和表 2 中的递增给药方案皮下注射本品,以降低细胞因子释放综合征 (CRS) 的发生率和严重程度。
• 按照推荐的逐步给药方案,在每次使用本品之前给予预处理药物。
• 本品只能由具有适当医疗支持的合格医疗保健专业人员进行给药,以处理严重反应,例如细胞因子释放综合征 (CRS)和神经毒性,包括免疫效应细胞相关神经毒性综合征 (ICANS)。
• 由于存在 CRS 和神经系统毒性(包括 ICANS)的风险,患者应在本品递增给药方案内的所有剂量给药后住院 48 小时。
2. 推荐剂量
用于皮下注射。
根据表 1 或表 2 按每周或每两周(每 2 周)给药方案皮下注射本品。持续治疗直至疾病进展或出现不可耐受的毒性。


3. 推荐的预处理药物
在递增给药方案中每次剂量TALVEY前1至3小时给予下列预处理药物以降低CRS风险。
• 皮质类固醇(口服或静脉注射地塞米松,16 mg或等效量)
• 抗组胺药(口服或静脉注射苯海拉明,50 mg或等效量)
• 退热药(口服或静脉注射对乙酰氨基酚,650 mg至 1,000 mg或等效量)
对于由于剂量延迟而在本品递增给药方案内重复给药的患者(见表 3 或表 4)或经历过 CRS 的患者(见表 5),后续剂量可能需要给予治疗前用药。
4. 制备和给药
由医疗保健提供者通过皮下注射本品。
本品应由拥有足够医务人员和适当医疗设备的医疗保健提供者管理,以处理严重反应,包括 CRS 和神经毒性,包括 ICANS。 TALVEY 3 mg/1.5 mL (2 mg/mL) 小瓶和 TALVEY 40 mg/mL 小瓶作为即用型注射溶液提供,给药前无需稀释。
请勿将不同浓度的本品瓶组合起来以获得治疗剂量。
使用无菌技术制备和注射本品。
a. 制备
本品的制备请参考以下参考表。
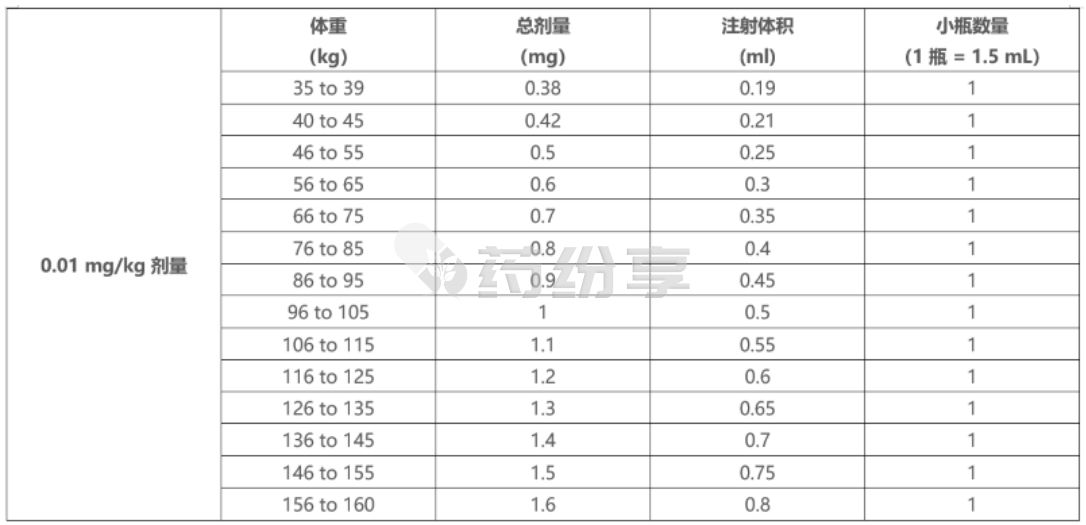
o 根据患者实际体重,使用表 9 确定使用 TALVEY 3 mg/1.5 mL (2 mg/mL) 小瓶注射 0.01 mg/kg 剂量所需的总剂量、注射体积和小瓶数量。
表 9:0.01 mg/kg 剂量:使用 TALVEY 3 mg/1.5 mL (2 mg/mL) 小瓶的注射体积
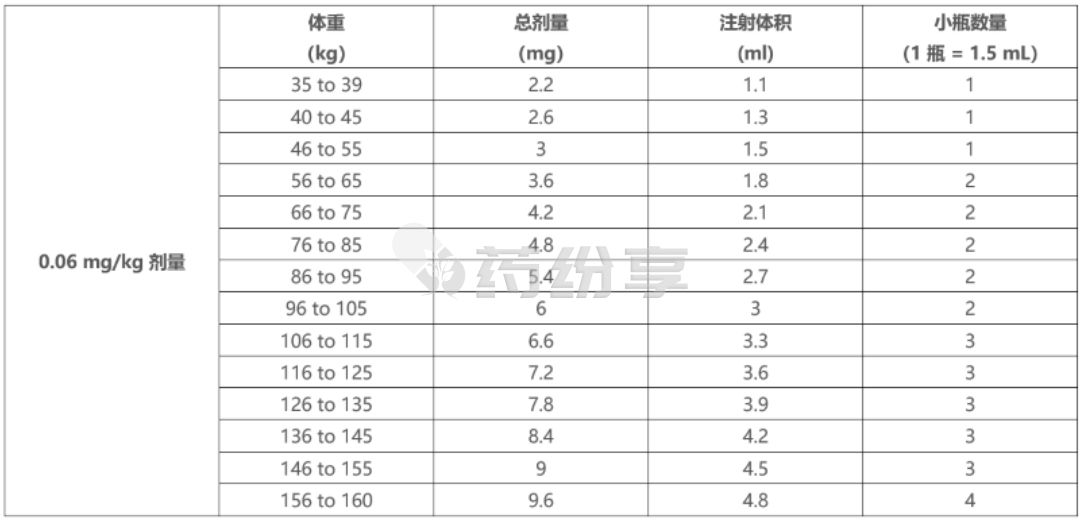
o根据患者实际体重,使用表 10 确定使用 TALVEY 3 mg/1.5 mL (2 mg/mL) 小瓶注射 0.06 mg/kg 剂量所需的总剂量、注射体积和小瓶数量。
表10:0.06 mg/kg 剂量:使用 TALVEY 3 mg/1.5 mL (2 mg/mL) 小瓶的注射体积
o根据患者实际体重,使用表 11 确定使用 TALVEY 40 mg/mL 小瓶注射 0.4 mg/kg 剂量所需的总剂量、注射体积和小瓶数量。
表11:0.4 mg/kg 剂量:使用 TALVEY40 mg/mL 小瓶的注射体积
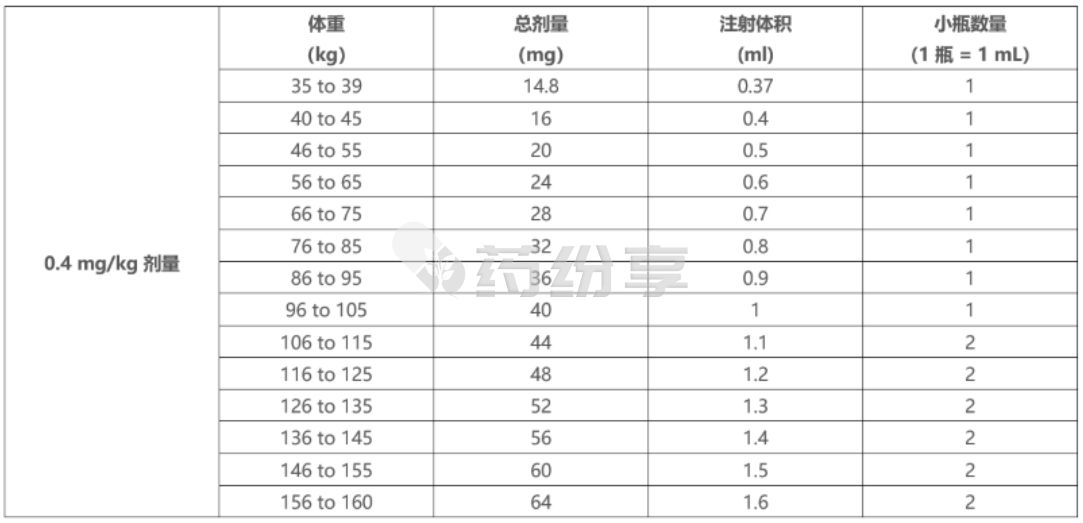
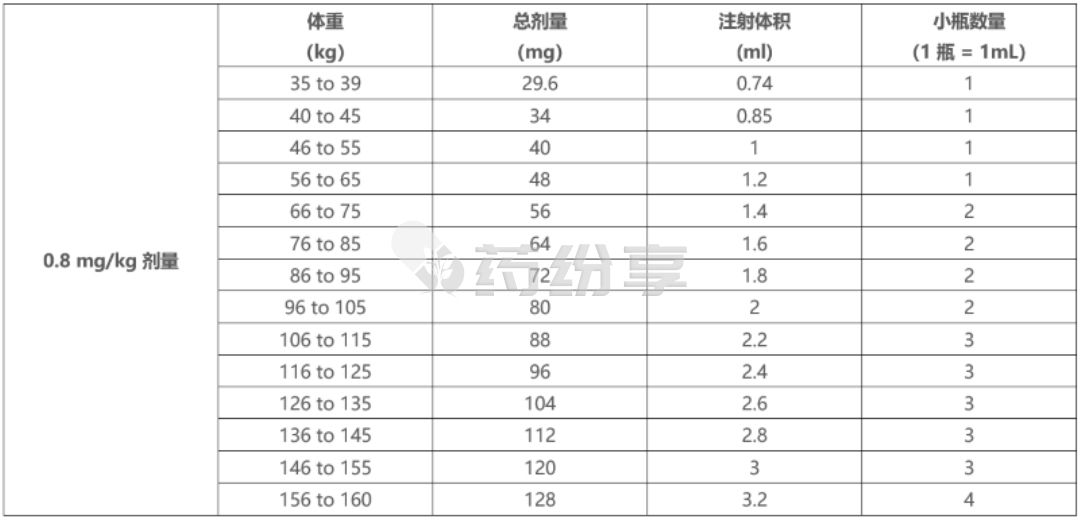
o根据患者实际体重,使用表 12 确定使用 TALVEY 40 mg/mL 小瓶注射 0.8 mg/kg 剂量所需的总剂量、注射体积和小瓶数量。
表12:0.8 mg/kg 剂量:使用 TALVEY 40 mg/mL 小瓶的注射体积
• 只要溶液和容器允许,肠外药物产品应在给药前目视检查是否有颗粒物质和变色。 检查注射用TALVEY溶液是否为无色至浅黄色。 如果溶液变色、混浊或存在异物,请勿使用。
• 从冷藏 2°C 至 8°C中取出适当强度的 TALVEY 小瓶,并平衡至环境温度 15°C 至 30°C 至少 15 分钟。 请勿以任何其他方式加热 TALVEY。
• 平衡温度后,轻轻旋转小瓶约10 秒以混合。 不要摇晃。
• 使用转移针(transfer needle)将所需的TALVEY 注射量从小瓶中抽入适当尺寸的注射器中。
o 每次注射体积不应超过 2 mL。 将需要大于 2 mL 的剂量平均分配到多个注射器中。
• TALVEY 与不锈钢注射针和聚丙烯或聚碳酸酯注射器材料兼容。
• 用适当尺寸的注射针更换转移针(transfer needle)。
b. 给药
• 将所需体积的TALVEY 注射到腹部皮下组织(首选注射部位)。 或者,TALVEY 可以注射到其他部位(例如大腿)的皮下组织中。 如果需要多次注射,TALVEY 注射间隔至少应为 2 cm。
• 请勿注射到纹身或疤痕或皮肤发红、瘀伤、压痛、坚硬或不完整的区域。
• 任何未使用的药品或废料应按照当地要求进行处置。
c. 贮存
准备好的注射器应立即使用。 如果无法立即给药,请将 TALVEY 溶液在 2°C 至 8°C的冷藏条件下保存最多 24 小时,然后在 15°C 至 30°C的室温下保存最多 24 小时。 如果冷藏保存超过 24 小时或室温保存超过 24 小时,请丢弃。 如果储存在冰箱中,请在给药前让溶液恢复至室温。
【剂量调整】
可能需要延迟剂量来控制与 TALVEY 相关的毒性。
有关 CRS、ICANS 和神经毒性管理的建议措施,请参阅表 5、表 6 和表 7。 其他不良反应的推荐剂量调整见表 8。
1. 细胞因子释放综合征 (CRS)
根据临床表现识别 CRS。 评估和治疗发烧、缺氧和低血压的其他原因。 如果怀疑 CRS,则暂停使用 TALVEY 直至 CRS 解决,或根据严重程度永久停用,根据表 5 中的建议进行管理,并考虑根据现行实践指南进行进一步管理。 对 CRS 进行支持性治疗,其中可能包括对严重或危及生命的 CRS 进行重症监护。 考虑进行实验室检测来监测弥散性血管内凝血 (DIC)、血液学参数以及肺、心、肾和肝功能。
表5:CRS的推荐管理措施
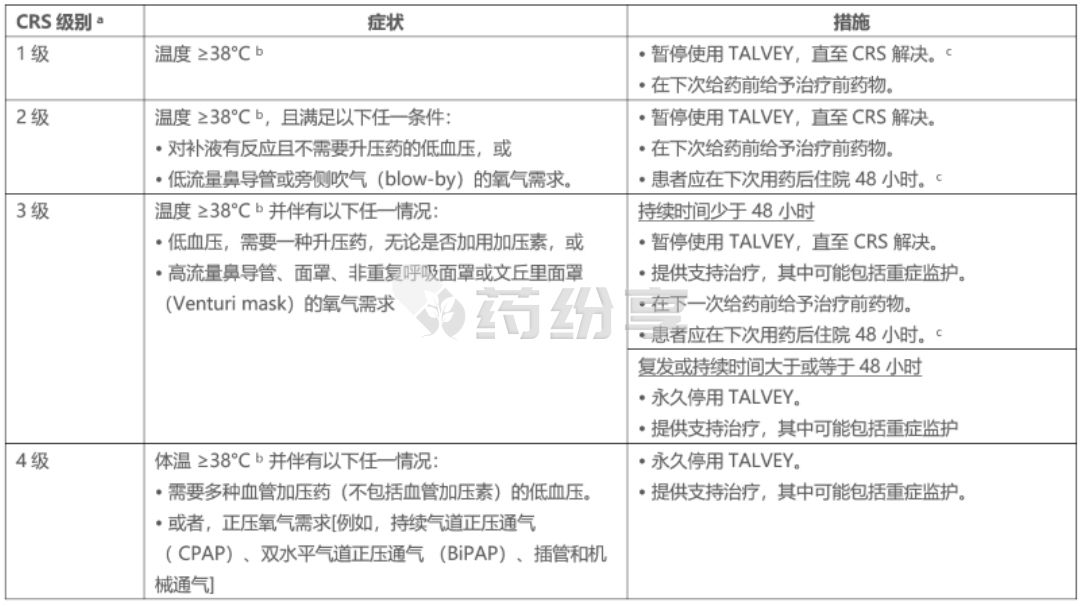
a 基于美国移植和细胞治疗协会 (ASTCT) 对 CRS 的分级(Lee et al 2019)。
b 归因于 CRS。 发烧可能并不总是与低血压或缺氧同时出现,因为发烧可能会被退热药或抗细胞因子治疗(例如皮质类固醇)等干预措施所掩盖。
c 因不良反应延迟给药后重新启动TALVEY的建议见表3和表4(见使用方法/延迟或漏药处理)。
d 低流量鼻导管≤6 L/min,高流量鼻导管>6 L/min。
2. 神经毒性,包括 ICANS
一旦出现神经毒性(包括 ICANS)的第一个体征,就停止使用 TALVEY 并考虑进行神经病学评估。 排除神经系统症状的其他原因。 对于严重或危及生命的神经毒性,包括ICANS,提供支持治疗,其中可能包括重症监护。 根据表 6 和表 7 中的建议管理 ICANS 和神经毒性,并考虑根据当前实践指南进行进一步管理。
表 6:ICANS 管理建议
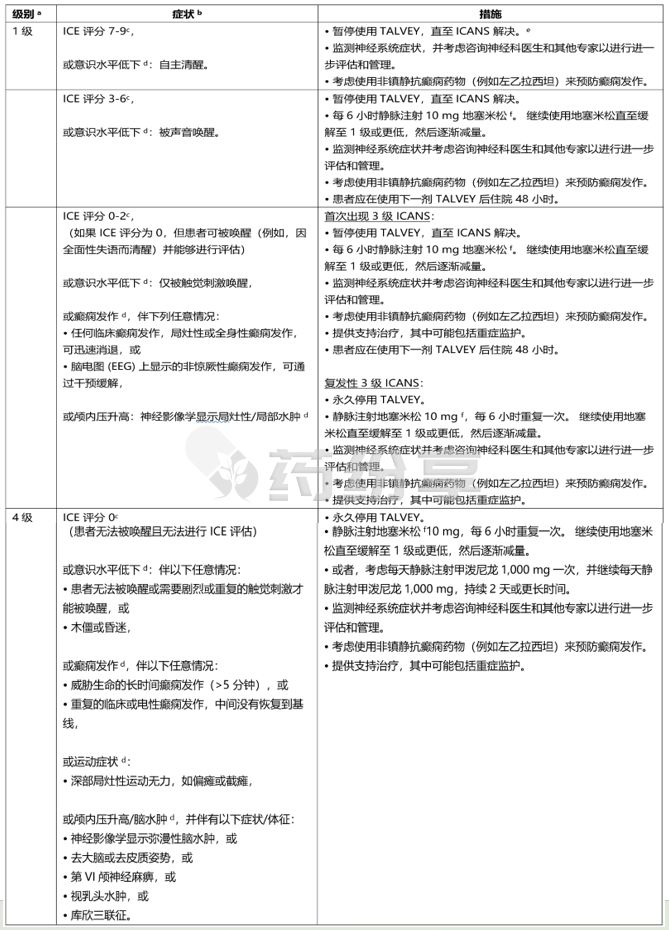
a 基于 ICANS 的 ASTCT 2019 评分。
b 处理由最严重的不可归因于任何其他原因的事件决定,
c 如果患者可被唤醒并能够进行免疫效应细胞相关脑病 (ICE) 评估,则评估: 定向(针对年、月、城市、医院 = 4 分); 命名(命名 3 个物体,例如指向时钟、笔、按钮 = 3 分); 遵循命令(例如,“给我看 2 根手指”或“闭上眼睛并伸出舌头”= 1 分); 写作(写出标准句子的能力 = 1 分;注意力(倒数100,十个 十个的数)。如果患者无法被唤醒并且无法进行 ICE 评估(4 级 ICANS)= 0 分。
d 不归因于其他
e 不良反应延迟给药后重新开始TALVEY 的建议见表3 和表4.
f 所有提及地塞米松给药的参考文献均为地塞米松或等效物。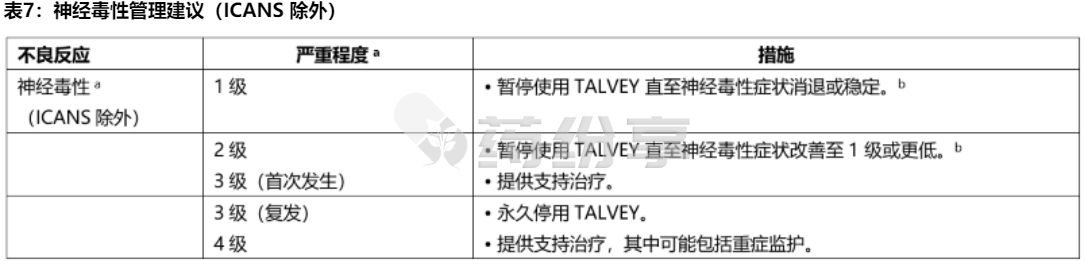
a 基于美国国家癌症研究所不良事件通用术语标准 (NCI CTCAE) 4.03 版。
b 有关因不良反应延迟给药后重新启动 TALVEY 的建议,请参见表 3 和表 4。
3. 其他不良反应
表 8 提供了其他不良反应的推荐剂量调整。
表 8:其他不良反应的推荐剂量调整
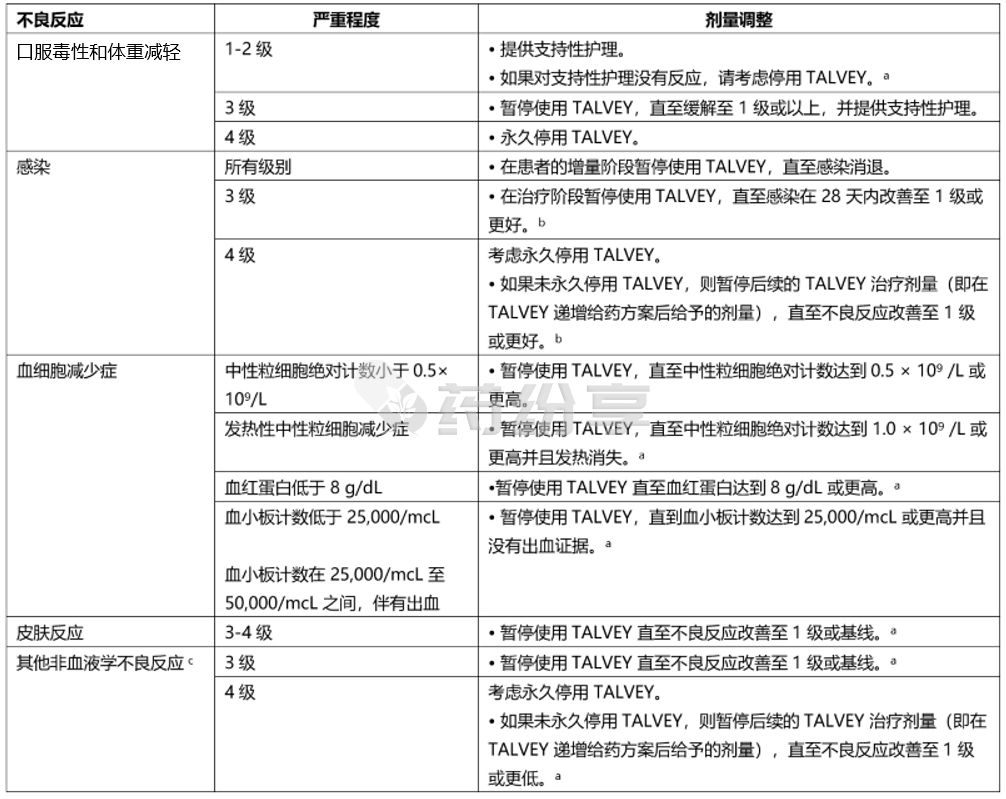
a 因不良反应延迟给药后重新启动 TALVEY 的建议见表 3 和表 4。
b 对于 3 级或 4 级感染,如果停用 TALVEY 超过 28 天,当感染改善至 1 级或更好时重新开始递增给药。
c 基于美国国家癌症研究所不良事件通用术语标准 (NCI-CTCAE),版本 4.03。
【延迟或遗漏给药】
如果TALVEY剂量被延迟,根据表3和表4中的建议重新开始治疗并相应地恢复每周或两周(每2周)给药方案; 如果因不良反应而延迟给药超过 28 天,则评估重新开始 TALVEY 的获益-风险。 在重新启动 TALVEY 之前给予治疗前用药,并在给予 TALVEY 后监测患者。
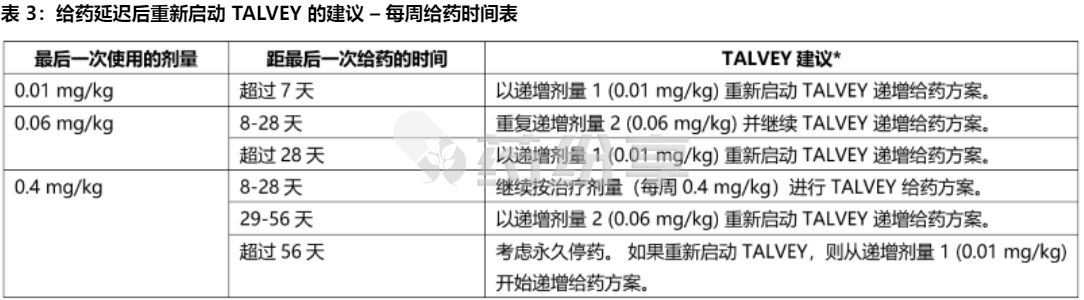
* 在重新启动 TALVEY 之前给予治疗前重要。 重新启动 TALVEY 后,相应地恢复每周给药计划。
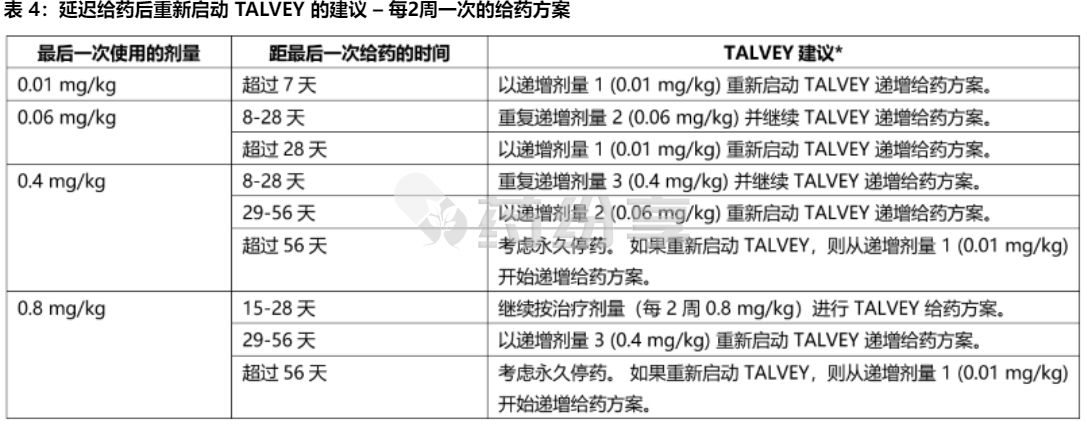
* 在重新启动 TALVEY 之前给予治疗前用药。 重新启动 TALVEY 后,相应恢复每两周一次的给药方案。
【过量处理】
无相关信息
【不良反应】
最常见的不良反应(≥20%):发热、细胞因子释放综合征(CRS)、味觉障碍、指甲异常、肌肉骨骼疼痛、皮肤异常、皮疹、疲劳、体重下降、口干、皮肤干燥 、吞咽困难、上呼吸道感染、腹泻、低血压和头痛。
最常见的3级或4级实验室异常(≥30%):淋巴细胞计数减少、中性粒细胞计数减少、白细胞减少和血红蛋白减少。
【注意事项】
-口服毒性和体重减轻:
监测口服毒性和体重减轻。 根据严重程度暂停或永久停药。
-感染:
可能导致严重、危及生命或致命的感染。 监测感染的症状和体征; 适当治疗。 根据严重程度暂停或考虑永久停药。
-血细胞减少:
监测全血细胞计数。
-皮肤毒性:
监测皮肤毒性,包括皮疹进展,以便早期干预和适当治疗。 根据严重程度按照建议暂停用药。
-肝毒性:
根据临床指征在基线和治疗期间监测肝酶和胆红素。 根据严重程度暂停或考虑永久停药。
-胚胎-胎儿毒性:
可能造成胎儿伤害。 告知有育龄期女性本品对胎儿的潜在风险并采取有效的避孕措施
【禁忌】
无
【特殊人群】
-妊娠期:
根据其作用机制,本品给孕妇服用时可能会造成胎儿伤害。
-哺乳期:
建议女性在使用本品治疗期间以及最终剂量后至少3个月内不要母乳喂养。
-儿童:
尚未确定本品对儿童患者的安全性和有效性。
-老年患者:
与年轻患者相比,65 岁至 74 岁以下患者的安全性或有效性没有总体差异。 与年轻患者相比,75 岁或以上患者的致命不良反应发生率更高。本品的临床研究没有包括足够数量的75岁及以上患者,以确定他们的反应是否与年轻患者不同。
【适应症】
本品是一种靶向GPRC5D和T细胞 CD3的双特异性结合抗体,适用于治疗复发性或难治性多发性骨髓瘤的成年患者,这些患者之前至少接受过四种疗法,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
【药物相互作用】
对于某些细胞色素 P450 (CYP) 底物,底物浓度的微小变化可能会导致严重的不良反应。 与本品共同给药时,监测此类 CYP 底物的毒性或药物浓度。
本品导致细胞因子释放,可能抑制CYP酶的活性,导致CYP底物暴露增加。 从本品递增给药方案开始至首次治疗剂量后 14 天以及 CRS 期间和之后,CYP 底物暴露增加更有可能发生。
请按药品说明书或在药师指导下购买和使用



 在线咨询
在线咨询 400-001-9769
400-001-9769
